─Éß╗Ö ─æiß╗ćn li là gì
Trong chŲ░ŲĪng trình hóa hß╗Źc phß╗Ģ thông ─æiß╗ćn li là quá trình thay ─æß╗Ģi ─æiß╗ćn tích cß╗¦a nguyß╗ćn tß╗Ł hay phß║¦n tß╗Ł tß╗½ Âm sang DŲ░ŲĪng hoß║Ęc ngŲ░ß╗Żc lß║Īi bß║▒ng viß╗ćc nhß║Łn thêm electron trong dung dß╗ŗch. Vß║Ły ─æß╗Ö ─æiß╗ćn li là gì và ý ngh─®a viß╗ćc tính ─æŲ░ß╗Żc ─æß╗Ö ─æiß╗ćn li, qua bài viß║┐t này sß║Į làm rõ nhß╗»ng vß║źn ─æß╗ü trên.
Chß║źt ─æiß╗ćn li
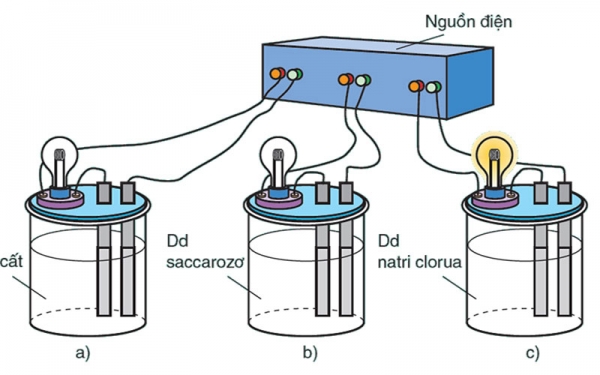
Trong thß╗▒c tß║┐ ngŲ░ß╗Øi ta thß║źy có nhß╗»ng dung dß╗ŗch có thß╗ā dß║½n ─æiß╗ćn còn lß║Īi thì không dß║½n ─æŲ░ß╗Żc, tß╗½ ─æó ngŲ░ß╗Øi ─æß║Ęt ra câu hß╗Åi tß║Īi sao dung dß╗ŗch A thì dß║½n ─æiß╗ćn mà dung dß╗ŗch B không dß║½n ─æŲ░ß╗Żc ─æiß╗ćn. Tß╗½ ─æó ngŲ░ß╗Øi ta nghiß╗ćn cß╗®u các chß║źt trong 2 dung dß╗ŗch và nhß║Łn thß║źy trong dung dß╗ŗch A có chß║źt ─æiß╗ćn li nên dß║½n ─æiß╗ćn ─æŲ░ß╗Żc còn dung dß╗ŗch B thì không có chß║źt ─æiß╗ćn li. Tóm lß║Īi ta có thß╗ā hiß╗āu chß║źt ─æiß╗ćn li là chß║źt:
- Chß║źt ─æiß╗ćn li là chß║źt tan ─æŲ░ß╗Żc trong nŲ░ß╗øc (dung môi là nŲ░ß╗øc)
- Phân li ─æŲ░ß╗Żc thành I-on
Dß║źu hiß╗ću nhß║Łn biß║┐t chß║źt ─æiß╗ćn li gß╗ōm: Axit, Ba-zŲĪ và muß╗æi
NaCl → Na + Cl2
HCl → H+ + Cl-
…
Chß║źt ─æiß╗ćn li ─æŲ░ß╗Żc phân loai:
- Chß║źt ─æiß╗ćn li mß║Īnh: Axit mß║Īnh, Bazo tan và muß╗æi tan (HCl, H2SO4, Na(OH), NACl,…)
- Chß║źt ─æiß╗ćn li yß║┐u: Axit yß║┐u, Ba-zŲĪ và muß╗æi ít tan (Na2CO3, H2CO3, Ag2SO4,…)
─Éß╗ā biß║┐t ─æŲ░ß╗Żc chß║źt ─æiß╗ćn li mß║Īnh hay yß║┐u ta sß║Į ─æi tính ─æß╗Ö ─æiß╗ćn li cß╗¦a chß║źt, vß║Ły tính ─æß╗Ö ─æiß╗ćn li nhŲ░ thß║┐ nào chúng ta cùng tìm hiß╗āu tiß║┐p theo dŲ░ß╗øi ─æây.
Công thß╗®c tính ─æß╗Ö ─æiß╗ćn li.
 *100%
*100%
Trong ─æó:
α là ─æß╗Ö ─æiß╗ćn li Alpha
![]() là sß╗æ mol chß║źt ─æã ─æiß╗ćn li
là sß╗æ mol chß║źt ─æã ─æiß╗ćn li
![]() là sß╗æ mol chß║źt ban ─æß║¦u
là sß╗æ mol chß║źt ban ─æß║¦u

![]() là hß║▒ng sß╗æ ─æiß╗ćn li.
là hß║▒ng sß╗æ ─æiß╗ćn li.
Dung dß╗ŗch ─æiß╗ćn li tß╗ōn tß║Īi
Dung dß╗ŗch chß║źt ─æiên li tß╗ōn tß║Īi cß║¦n thß╗Åa mãn ─æß╗ōng thß╗Øi 2 ─æiß╗üu kiß╗ćn:
- ─Éß║Żm bß║Żo nguyên tß║»c trung hòa vß╗ü ─æiß╗ćn tích trong dung dß╗ŗch (tß╗Ģng sß╗æ ─æiß╗ćn tích âm phß║Żi bß║▒ng tß╗Ģng sß╗æ ─æiß╗ćn tích dŲ░ŲĪng).
Sß╗æ mol─æiß╗ćn tích = sß╗æ molion.─æiên tíchion
- Các i-on trong dung dß╗ŗch không ─æôi mß╗Öt phß║Żn ß╗®ng vß╗øi nhau.
Xu hŲ░ß╗øng xß║Ży ra các phß║Żn ß╗®ng cß╗¦a các ion trong dung dß╗ŗch thŲ░ß╗Øng tß║Īo sß║Żn phß║®m là: sß║Żn phß║®m kß║┐t tß╗¦a, sinh ra chß║źt khí, tß║Īo dun dß╗ŗch ─æiß╗ćn li yß║┐u (Các i-on có tính khß╗Ł sß║Į phß║Żn ß╗®ng vß╗øi i-on có tính oxi hóa theo cŲĪ chß║┐ phß║Żn ß╗®ng Oxi hóa -Khß╗Ł).
Phß║Żn ß╗®ng trao ─æß╗Ģi i- on
- Các phß║Żn ß╗®ng xß║Ży ra trong dung dß╗ŗch ─æiß╗ćn li chính là sß╗▒ phß║Żn ß╗®ng giß╗»a các i-on cß╗¦a chß║źt ─æiß╗ćn li.
- ─Éiß╗üu kiß╗ćn xß║Ży ra phß║Żn ß╗®ng trao ─æß╗Ģi ion trong dung dß╗ŗch các chß║źt ─æiß╗ćn li là khi các ion kß║┐t hß╗Żp ─æŲ░ß╗Żc vß╗øi nhau tß║Īo thành ít nhß║źt 1 trong sß╗æ các sß║Żn phß║®m sau:
- Chß║źt kß║┐t tß╗¦a.
- Chß║źt ─æiß╗ćn li yß║┐u.
- Chß║źt khí.
Dß║Īng 1: Bài toán liên quan tính nß╗ōng ─æß╗Ö các chß║źt
PhŲ░ŲĪng pháp giß║Żi
- Viß║┐t phŲ░ŲĪng trình ─æiß╗ćn li hóa hß╗Źc
- Dß╗▒a vào yêu cß║¦u bài toán và dß╗» liß╗ću, xác ─æß╗ŗnh sß╗æ mol các chß║źt trong trong dung dß╗ŗch theo phŲ░ŲĪng trình phß║Żn ß╗®ng (─Éß║¦u, Phß║Żn ß╗®ng và cân bß║▒ng sŲĪ ─æß╗ō 3 dòng).
Ví dß╗ź 1. Cho hß╗Ś hß╗Żp dung dß╗ŗch gß╗ōm 100 ml dung dß╗ŗch và NaCl 0,10M vào 100ml dung dß╗ŗch Na2SO4 0,10M. Tính nß╗ōng ─æß╗Ö các i-on trong dung dß╗ŗch sau phß║Żn ß╗®ng.
Lß╗Øi giß║Żi
NaCl và Na2SO4 là chß║źt ─æiß╗ćn li mß║Īnh tß╗½ ─æó: NaCl à Na+ + Cl- (1); Na2SO4 à2Na+ + (SO4)2- (2) 0.01 0.01 0.01 ; 0.01 0.02 0.01
0.01 + 0.02 = 0.15M; [Cl-] = 0.05M; [(SO4)2-]= 0.05M
Ví dß╗ź 2. Tính nß╗ōng ─æß╗Ö mol cß╗¦a các chß║źt trong dung dß╗ŗch CH3COOH, CH3COO-, H+ tß║Īi cân bß║▒ng trong dung dß╗ŗch CH3COOH 0.1M có a = 1.32%.
Bài giß║Żi
CH3COOH : H+ + CH3COO- (1)
Ban ─æß║¦u: Co 0 0
Phß║Żn ß╗®ng: Co. a Co. a Co. a
Cân bß║▒ng: Co(1-a) Co. a Co. a
Vß║Ły: [H+]= [CH3COO-] = a*Co = 0.1* 1.32*10-2M = 1.32*10-3M [CH3COOH] = 0.1M – 0.00132M = 0.09868M
Dß║Īng 2: Tính ─æß╗Ö ─æiß╗ćn li Alpha cß╗¦a các chß║źt có trong dung dß╗ŗch
PhŲ░ŲĪng pháp giß║Żi
- Viß║┐t phŲ░ŲĪng trình ─æiß╗ćn li hóa hß╗Źc
- Dß╗▒a vào yêu cß║¦u bài toán và dß╗» liß╗ću, xác ─æß╗ŗnh sß╗æ mol các chß║źt trong trong dung dß╗ŗch theo phŲ░ŲĪng trình phß║Żn ß╗®ng (─Éß║¦u, Phß║Żn ß╗®ng và cân bß║▒ng sŲĪ ─æß╗ō 3 dòng).
Ví dß╗ź 1. Trong 1 lít dung dß╗ŗch CH3COOH nß╗ōng ─æß╗Ö 0.02M có chß╗®a 1.2407*1022 phân tß╗Ł chŲ░a phân li và i-on. Tính ─æß╗Ö ─æiß╗ćn li Alpha cß╗¦a CH3COOH ß╗¤ mß╗®c nß╗ōng ─æß╗Ö trên, biß║┐t sß╗æ mol ban ─æß║¦u là 6.022*1023.
Bài giß║Żi
CH3COOH : H+ + CH3COO- (1)nCH COOH = 0.02 mol , Sß╗æ phân tß╗Ł ban ─æß║¦u là: n0 = 1. 0,02.6,022.1023 = 1,2044.1022 phân tß╗Ł
Ban ─æß║¦u n0
Phß║Żn ß╗®ng n n n
Cân bß║▒ng (n0-n) n n
ß╗× trß║Īng thái cân bß║▒ng thì sß╗æ i-on chŲ░a phân li và các ion là: (n0 – n) + n + n = 1.2047*1022
Có n = 1.2047*1022 – 1.2044*1022 = 0.0363*1022.
Ví dß╗ź 2. Tính ─æß╗Ö ─æiß╗ćn li Alpha cß╗¦a chß║źt ─æiß╗ćn li HCOOH 0,007M trong dung dß╗ŗch có nß╗ōng ─æß╗Ö [H+]=0.001M Bài giß║Żi
HCOOH + H2O : H- + H3O+
Ban ─æß║¦u: 0,007 0
Phß║Żn ß╗®ng: 0,007. a 0,007. A
Cân bß║▒ng: 0,007(1-a) 0,007. a
Tß╗½ phŲ░ŲĪng trình trên ta có: [H+] = 0,007* a (M) 0.007* a= 0.001
Ví dß╗ź 3.
a) Tính ─æß╗Ö ─æiß╗ćn li Alpha cß╗¦a dung dß╗ŗch NH3 0.010M.
b) ─Éß╗Ö ─æiß╗ćn li biß║┐n thiên nhŲ░ thß║┐ nào
- Pha loãng dung dß╗ŗch ra 50 lß║¦n.
- Khi có mß║Ęt NaOH 0,0010M.
Bài giß║Żi
─Éß╗Ö ─æiß╗ćn li t─āng vì nß╗ōng ─æß╗Ö nhß╗Å có mß║Łt ─æß╗Ö ion càng giß║Żm thì khß║Ż n─āng tŲ░ŲĪng tác giß╗»a các ion làm giß║Żm nß╗ōng ─æß╗Ö ─æiß╗ćn li, t─āng ─æß╗Ö ─æiß╗ćn li.
* Khi NaOH 0.0010M: NaOH à Na+ + OH-
Nhß║Łn xét: α giß║Żm vì nß╗ōng ─æß╗Ö OH -trong dung dß╗ŗch NaOH làm chuyß╗ān dß╗ŗch cân bß║▒ng sang trái.
Dß║Īng 3: Tính nß╗ōng ─æß╗Ö pH cß╗¦a dung dß╗ŗch khi Alpha (α) và các hß║▒ng sß╗æ Ka , Kb
PhŲ░ŲĪng pháp giß║Żi
- PhŲ░ŲĪng trình ─æiß╗ćn li.
- Biß╗āu diß╗ģn sß╗æ mol các chß║źt trong phŲ░ŲĪng trình theo tß╗½ng thß╗Øi ─æiß╗ām (trß║Īng thái ban ─æß║¦u, khi phß║Żn ß╗®ng và trß║Īng thái cân bß║▒ng) tùy theo yêu cß║¦u và dß╗» kiß╗ćn bài toán.
- Vß╗øi các chß║źt ─æiß╗ćn li yß║┐u là axit KA: KA à K+ + A-.
- Tính ─æß╗Ö pH cß╗¦a dung dß╗ŗch axit: Xác ─æß╗ŗnh nß╗ōng ─æß╗Ö mol cß╗¦a H+ trong dung dß╗ŗch khi cân bß║▒ng pH=-lg([H+])
- Tính nß╗ōng ─æß╗Ö pH cß╗¦a ba-zŲĪ: Tính nß╗ōng ─æß╗Ö mol cß╗¦a i-on OH- trong dung dß╗ŗch sau khi cân bß║▒ng hoß║Ęc pH = 14 -pOH = 14 + lg([OH-]).
Tóm lß║Īi ─Éß╗Ö ─æiß╗ćn li là giá trß╗ŗ thß╗ā hiß╗ćn tß╗Ę lß╗ć phân li thành các i-on cß╗¦a các chß║źt trong dung dß╗ŗch tß║Īo ra môi trŲ░ß╗Øng i-on. Hy vß╗Źng qua bài viß║┐t các bß║Īn ─æã có cho mình câu trß║Ż lß╗Øi cho câu hß╗Åi ─Éß╗Ö ─æiß╗ćn li là gì?
.png)