Thß║┐ ─æiß╗ćn cß╗▒c là gì
Thß║┐ ─æiß╗ćn cß╗▒c là hiß╗ćn tŲ░ß╗Żng hóa hß╗Źc dùng ─æß╗ā chß╗ē sß╗▒ xuß║źt hiß╗ćn cß╗¦a dòng ─æiß╗ćn ─æi tß╗½ cß╗▒c dŲ░ŲĪng (+) sang cß╗▒c âm (-) hay còn chính là sß╗▒ chênh lß╗ćch ─æiß╗ćn thß║┐ giß╗»a 2 ─æiß╗ćn cß╗▒c tß╗½ ─æó xuß║źt hiß╗ćn thß║┐ ─æiß╗ćn cß╗▒c ß╗¤ mß╗Śi cß╗▒c .
Thß║┐ ─æiß╗ćn cß╗▒c là gì? Khái niß╗ćm thß║┐ ─æiß╗ćn cß╗▒c
Khái niß╗ćm ─æiß╗ćn cß╗▒c ─æŲ░ß╗Żc ─æß╗ŗnh ngh─®a là mß╗Öt hß╗ć thß╗æng bao gß╗ōm mß╗Öt kim loß║Īi hoß║Ęc mß╗Öt vß║Łt dß║½n loß║Īi 1 (kim loß║Īi, bargraphit) nß║▒m tiß║┐p xúc vß╗øi vß║Łt dß║½n loß║Īi 2 (dung dß╗ŗch cß╗¦a chß║źt ─æiß╗ćn phân nóng chß║Ży hoß║Ęc chß║źt ─æiß╗ćn phân). Ta coi ─æiß╗ćn cß╗▒c kim loß║Īi M nhúng vào dung dß╗ŗch chß╗®a cationMn + cß╗¦a kim loß║Īi ─æó là: M / Mn +. Trên bß╗ü mß║Ęt ─æiß╗ćn cß╗▒c xuß║źt hiß╗ćn lß╗øp ─æiß╗ćn kép do sß╗▒ chuyß╗ān cß╗¦a cation Mn + tß╗½ bß╗ü mß║Ęt kim loß║Īi vào dung dß╗ŗch và ngŲ░ß╗Żc lß║Īi tß╗½ dung dß╗ŗch vào bß╗ü mß║Ęt ─æiß╗ćn cß╗▒c và xuß║źt hiß╗ćn trên bß╗ü mß║Ęt ─æiß╗ćn cß╗▒c. Do ─æó, sß╗▒ xuß║źt hiß╗ćn trên bß╗ü mß║Ęt ranh giß╗øi ─æiß╗ćn cß╗▒c / dung dß╗ŗch là tß╗▒ phát và giá trß╗ŗ này ─æŲ░ß╗Żc coi là tuyß╗ćt ─æß╗æi. Không thß╗ā xác ─æß╗ŗnh ─æŲ░ß╗Żc thß║┐ ─æiß╗ćn cß╗▒c tuyß╗ćt ─æß╗æi này, nhŲ░ng chß╗ē có thß╗ā ─æo ─æiß╗ćn thß║┐ tŲ░ŲĪng ─æß╗æi cß╗¦a nó khi so sánh vß╗øi ─æiß╗ćn cß╗▒c ─æŲ░ß╗Żc sß╗Ł dß╗źng làm ─æiß╗ćn cß╗▒c so sánh.
NgŲ░ß╗Øi ta thŲ░ß╗Øng sß╗Łdß╗źng ─æiß╗ćn cß╗▒c hydro tiêu chuß║®n (có hoß║Īt ─æß╗Ö H+ = 1và áp suß║źt H2= 1 atm) vß╗øi chß║źp nhß║Łn22/0.00oHHVŽĢ +=làm ─æiß╗ćn cß╗▒c so sánh. ─Éß╗ā ─æo thß║┐─æiß╗ćn cß╗▒c cß╗¦a mß╗Öt ─æiß╗ćn cß╗▒c kim loß║Īi nào ─æó (thß║┐chuß║®n nß║┐u hoß║Īt ─æß╗Ö Mn+ = 1) thì ngŲ░ß╗Øi ta lß║Łp mß║Īch─æiß╗ćn hóa gß╗ōm ─æiß╗ćn cß╗▒c hidro tiêu chuß║®n ─æŲ░ß╗Żc ─æß║Ętbên trái cß╗¦a hß╗ć ─æiß╗ćn hóa và ─æiß╗ćn cß╗▒c khß║Żo sát ─æŲ░ß╗Żc─æß║Ęt bên phía phß║Żi cß╗¦a (Theo quy Ų░ß╗øc cß╗¦a IUPACtß║Īi Hß╗Öi nghß╗ŗ Hóa hß╗Źc lý thuyß║┐t và ß╗®ng dß╗źng tß║Īi Stockholm 1953
Thß║┐ ─æiß╗ćn cß╗▒c chuß║®n là gì?
- ─Éiß╗ćn cß╗▒c Hidro chuß║®n
Tß║źm platin (Pt) nhúng trong dung dß╗ŗch axit có nß╗ōng ─æß╗Ö ion H + là 1 M. Bß╗ü mß║Ęt bß╗ŗ khí hi─æro hß║źp phß╗ź dŲ░ß╗øi áp suß║źt 1atm. E02H + / H2 = 0,00 V.
- Thß║┐ ─æiß╗ćn cß╗▒c chuß║®n kim loß║Īi:
─Éiß╗ćn cß╗▒c KL mà nß╗ōng ─æß╗Ö cß╗¦a ion KL trong dung dß╗ŗch là 1M ─æŲ░ß╗Żc gß╗Źi là ─æiß╗ćn cß╗▒c so sánh.
─Éiß╗ćn thß║┐ chuß║®n cß╗¦a KL cß║¦n ─æo ─æŲ░ß╗Żc chß║źp nhß║Łn bß║▒ng sdd cß╗¦a pin tß║Īo ra bß╗¤i ─æiß╗ćn cß╗▒c so sánh hydro và ─æiß╗ćn cß╗▒c so sánh cß╗¦a KL cß║¦n ─æo.
Nß║┐u KL ─æóng vai trò là cß╗▒c âm thì thß║┐ ─æiß╗ćn cß╗▒c tiêu chuß║®n cß╗¦a KL là cß╗▒c âm. Nß║┐u ─æiß╗ćn cß╗▒c dŲ░ŲĪng là KL thì thß║┐ ─æiß╗ćn cß╗▒c chuß║®n cß╗¦a KL là dŲ░ŲĪng.
Pin ─æiß╗ćn hóa
Sß╗®c ─æiß╗ćn ─æß╗Öng cß╗¦a pin (E) là hiß╗ću sß╗æ cß╗¦a ─æiß╗ćn thß║┐ dŲ░ŲĪng (E (+)) và ─æiß╗ćn cß╗▒c âm (E (-)). ─Éiß╗ćn cß╗▒c dŲ░ŲĪng là ─æiß╗ćn cß╗▒c có thß║┐ n─āng lß╗øn hŲĪn và suß║źt ─æiß╗ćn ─æß╗Öng cß╗¦a pin luôn dŲ░ŲĪng.
E = E(+) – E(-)
Suß║źt ─æiß╗ćn ─æß╗Öng chuß║®n cß╗¦a pin (Eo) là suß║źt ─æiß╗ćn ─æß╗Öng khi nß╗ōng ─æß╗Ö ion kim loß║Īi ß╗¤ ─æiß╗ćn cß╗▒c bß║▒ng 1M (ß╗¤ 25oC)
Eo = Eo(+) – Eo(-) hoß║Ęc Eo = Eocatot – Eoanot
Ví dß╗ź Eo = EoCu2 + / Cu - EoZn2 + / Zn ─æŲ░ß╗Żc gß╗Źi là suß║źt ─æiß╗ćn ─æß╗Öng chuß║®n cß╗¦a pin ─æiß╗ćn hóa Zn - Cu
Ý ngh─®a dãy thß║┐ ─æiß╗ćn cß╗▒c kim loß║Īi
- So sáng tính Oxi hóa khß╗Ł: Trong dung dß╗ŗch nŲ░ß╗øc, thß║┐ ─æiß╗ćn cß╗▒c chuß║®n cß╗¦a KL E0Mn + / M càng lß╗øn thì tính oxi hóa cß╗¦a cation Mn + càng yß║┐u và khß║Ż n─āng khß╗Ł cß╗¦a KL M. càng yß║┐u (ngŲ░ß╗Żc lß║Īi).
- Xác ─æß╗ŗnh ─æŲ░ß╗Żc chiß╗üu xß║Ży ra cß╗¦a phß║Żn ß╗®ng Oxi Hóa-khß╗Ł:
Cation kim loß║Īi trong cß║Ęp oxi hóa - khß╗Ł có giá trß╗ŗ thß║┐ ─æiß╗ćn cß╗▒c chuß║®n lß╗øn hŲĪn có thß╗ā oxi hóa kim loß║Īi trong cß║Ęp có giá trß╗ŗ thß║┐ ─æiß╗ćn cß╗▒c chuß║®n nhß╗Å hŲĪn.
Dß╗▒a vào giá trß╗ŗ thß║┐ ─æiß╗ćn cß╗▒c chuß║®n cß╗¦a kim loß║Īi ─æß╗ā sß║»p xß║┐p nhß╗Å bên trái, lß╗øn bên phß║Żi.
viß║┐t các phŲ░ŲĪng trình phß║Żn ß╗®ng theo quy tß║»c anpha ().
Kim loß║Īi trong cß║Ęp oxi hoá - khß╗Ł có thß║┐ âm khß╗Ł ion H + cß╗¦a dung dß╗ŗch axit.
- Xác ─æß╗ŗnh giá trß╗ŗ suß║źt ─æiß╗ćn ─æß╗Öng chuß║®n cß╗¦a pin ─æiß╗ćn hóa hß╗Źc:
Epin = E (+) - E (-)
Suß║źt ─æiß╗ćn ─æß╗Öng cß╗¦a pin ─æiß╗ćn hoá luôn dŲ░ŲĪng
- Xác ─æß╗ŗnh thß║┐ ─æiß╗ćn cß╗▒c chuß║®n cß╗¦a cß║Ęp oxi hóa-khß╗Ł:
Eopin X-Y = EoYn + / Y - EoXm + / X
Khi biß║┐t Eopin X-Y, nß║┐u bß║Īn biß║┐t EoYn + / Y Þ EoXm + / X
Ví dß╗ź:
Xác ─æß╗ŗnh EoNi2 + / Ni. Biß║┐t Eopin Ni-Cu = 0,60 V, EoCu2 + / Cu = 0,34V
Eopin Ni-Cu = EoCu2 + / Cu - EoNi2 + / Ni
Þ EoNi2 + / Ni = 0,34 - 0,6 = -0,26 V
Vai trò cß╗¦a pin ─æiß╗ćn hóa trong thß╗▒c tiß╗ģn cuß╗Öc sß╗æng
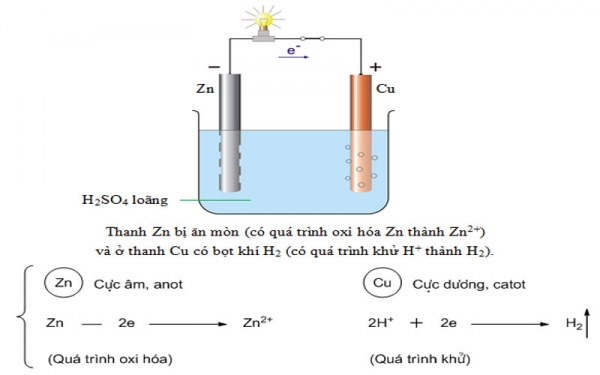
Pin là thiß║┐t bß╗ŗ dùng ─æß╗ā lŲ░u trß╗» và cung cß║źp ─æiß╗ćn n─āng. Pin ─æiß╗ćn hóa chuyß╗ān hóa n─āng lŲ░ß╗Żng (n─āng lŲ░ß╗Żng phß║Żn ß╗®ng hóa hß╗Źc) thành ─æiß╗ćn n─āng.─Éß╗ā tß║Īo ra mß╗Öt pin ─æiß╗ćn hóa rß║źt ─æŲĪn giß║Żn, vß╗øi mß╗Öt quß║Ż chanh và hai miß║┐ng kim loß║Īi (mß╗Öt miß║┐ng là ─æß╗ōng, miß║┐ng kia là kß║Įm)
Bên trong quß║Ż chanh có dung dß╗ŗch axit sunfuric loãng H2SO4 có thß╗ā tác dß╗źng lên các cß╗▒c kim loß║Īi tß║Īo thành hß║Īt tß║Żi ─æiß╗ćn tß╗▒ do. Thß╗Ł vß╗øi ─æß╗ōng hß╗ō vß║Īn n─āng, giß╗»a hai cß╗▒c kim loß║Īi sß║Į có suß║źt ─æiß╗ćn ─æß╗Öng, nß║┐u trùng vß╗øi cß╗▒c cß╗¦a ─æß╗ōng hß╗ō sß║Į ─æß╗Źc âm. Sau ─æó, bß║Īn có mß╗Öt pin ─æiß╗ćn hóa.
Giß║Żi thích dòng ─æiß╗ćn trong Pin chanh ß╗¤ trên:
Do tác dß╗źng hóa hß╗Źc cß╗¦a ion kß║Įm Zn2 + tß╗½ thanh kß║Įm sß║Į ─æi vào dung dß╗ŗch axit sunfuric loãng => thanh kß║Įm thß╗½a electron nên tích ─æiß╗ćn âm (catot), mß║Ęt khác, ion H + trong dung dß╗ŗch bám vào cß╗▒c ─æß╗ōng thu êlectron trong thanh ─æß╗ōng => thanh ─æß╗ōng mß║źt êlectron nên nhiß╗ģm ─æiß╗ćn dŲ░ŲĪng (cß╗▒c dŲ░ŲĪng).
NhŲ░ vai trò quan trß╗Źng nhß║źt cß╗¦a pin ─æiß╗ćn hóa là giúp hiß╗āu ─æŲ░ß╗Żc cŲĪ chß║┐ sang sinh ra nguß╗ōn ─æiß╗ćn (Hóa- ─Éiß╗ćn) hóa hß╗Źc.
Tóm lß║Īi, qua bài viß║┐t thß║┐ ─æiß╗ćn cß╗▒c là gì bên trên chúng tôi hy vß╗Źng cung cß║źp ─æŲ░ß╗Żc nhß╗»ng thông tin bß╗Ģ ích vß╗ü thß║┐ ─æiß╗ćn cß╗▒c là gì, c┼®ng nhŲ░ ß╗®ng dß╗źng và vai trò cß╗¦a nó trong thß╗▒c tiß╗ģn cuß╗Öc sß╗æng.
.png)